Biópsia líquida – uma alternativa flexível e conveniente à amostragem de tecido
A biópsia líquida utiliza fluidos corporais para avaliar o estado de saúde, sendo mais frequentemente empregue na detecção da presença de cancros no plasma. A biópsia de tecido é atualmente o método de referência, mas nem sempre está disponível ou pode ser muito difícil de obter (por exemplo, no cancro do pulmão).
Uma biópsia líquida pode ser usada para ajudar a encontrar o cancro num estádio inicial, bem como para ajudar a planear o tratamento, para descobrir se o tratamento está a funcionar ou se o cancro voltou. A colheita de várias amostras de sangue ao longo do tempo também pode ajudar os médicos a entender que tipo de alterações moleculares estão a ocorrer num tumor e como isso poderá influenciar a terapia.
O que é uma biópsia líquida?
A biópsia líquida utiliza fluidos corporais para avaliar o estado de saúde, sendo mais frequentemente empregue na detecção da presença de cancros no plasma. Como alvo, podem ser usados ADN tumoral circulante (ADNct), células tumorais circulantes e muitas outras substâncias (Fig.1), das quais o ADNct é o mais amplamente utilizado.
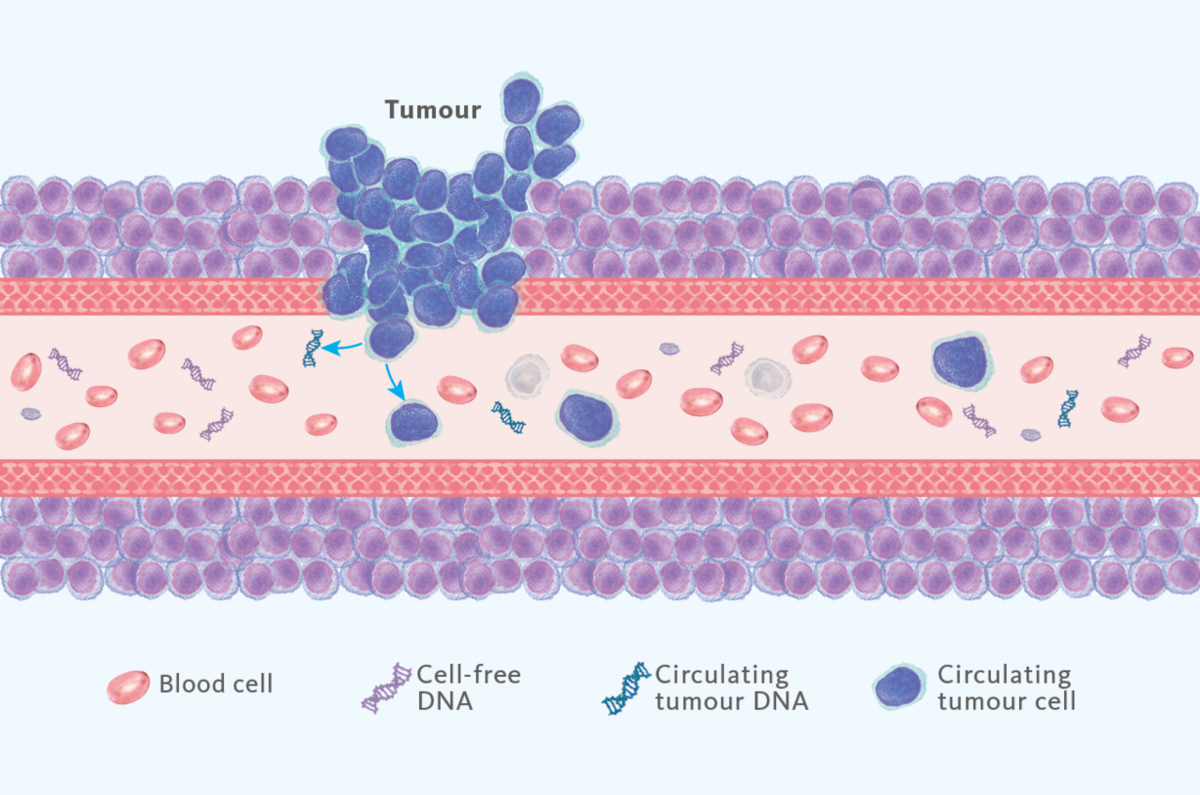
A biópsia de tecido é atualmente o método de referência, mas nem sempre está disponível ou pode, em determinados casos, ser muito difícil de obter (por exemplo, no cancro do pulmão). Também não é prático utilizar amostras de tecido em rotina para o seguimento dos doentes. Pelo contrário, a biópsia líquida é um método não invasivo conveniente para obter este tipo de informação para progredir nos estudos clínicos. Assim, a biópsia líquida já foi incluída em algumas orientações oncológicas, incluindo aquelas em cancro do pulmão, cancro colorretal e cancro da mama.
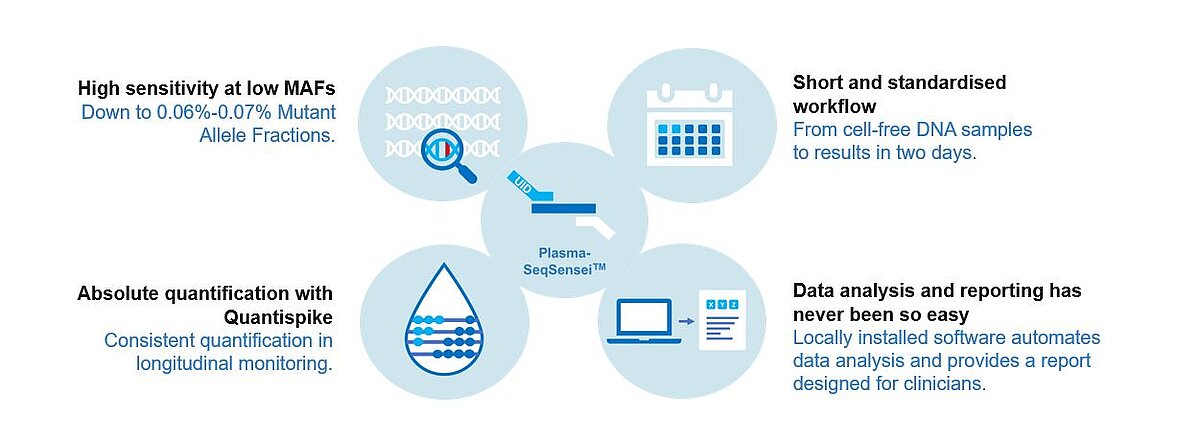
A nossa tecnologia OncoBEAM™ tem sido a tecnologia mais sensível disponível por um fator de quase 20x em relação a outras tecnologias de rotina, como PCR (reação em cadeia da polimerase) e NGS convencional (sequenciação de próxima geração). SafeSEQ, a tecnologia de base da nova linha de produtos Plasma-SeqSensei™, oferece uma sensibilidade semelhante combinada com uma maior conveniência de fluxo de trabalho. A sensibilidade é obtida com a utilização de um código de barras em cada amostra, reduzindo, assim, as taxas de erro em >100x.
Porquê utilizar a biópsia líquida?
- Alta concordância com amostras de tecido na maioria dos cancros
- Amostras de tecido obtidas de forma minimamente invasiva podem ser difíceis de obter
- Maior custo-efetividade do que a biópsia de tecido
- Mais conveniente para médicos e doentes
- Informação holística do tumor (as amostras de tecido podem não ser representativas devido a erros de amostragem)
- Tempo de resposta (TAT) mais rápido, em comparação com a manipulação de amostras de tecido
- Permite a repetição da amostragem, ao contrário das amostras de tecido
- Informação em tempo real
Porquê usar o Plasma-SeqSensei™?
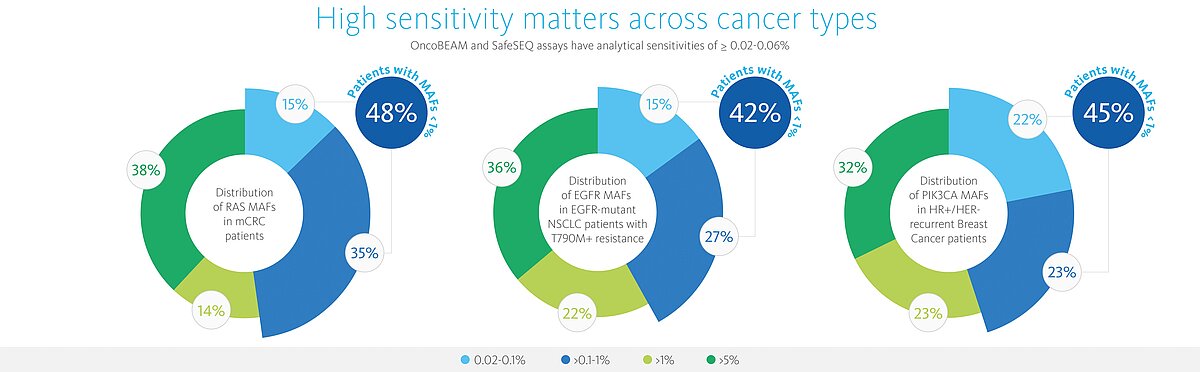
- Altamente sensível – capaz de detectar 7 MM (moléculas mutantes) com 95% de confiança relativamente a todas as mutações (quantificação absoluta) e correspondente a uma sensibilidade de até 0,07% MAF (frequência de alelos mutantes, aprox. 40% das amostras têm MAF abaixo do limite de deteção da maioria das tecnologias)
- Alta flexibilidade para 2 a 16 amostras/análise
- Alta eficiência laboratorial, pois vários tipos diferentes de amostras podem ser processados numa única análise
- Fluxo de trabalho padronizado, alta reprodutibilidade
- TAT rápido (2 dias)
- Software conveniente
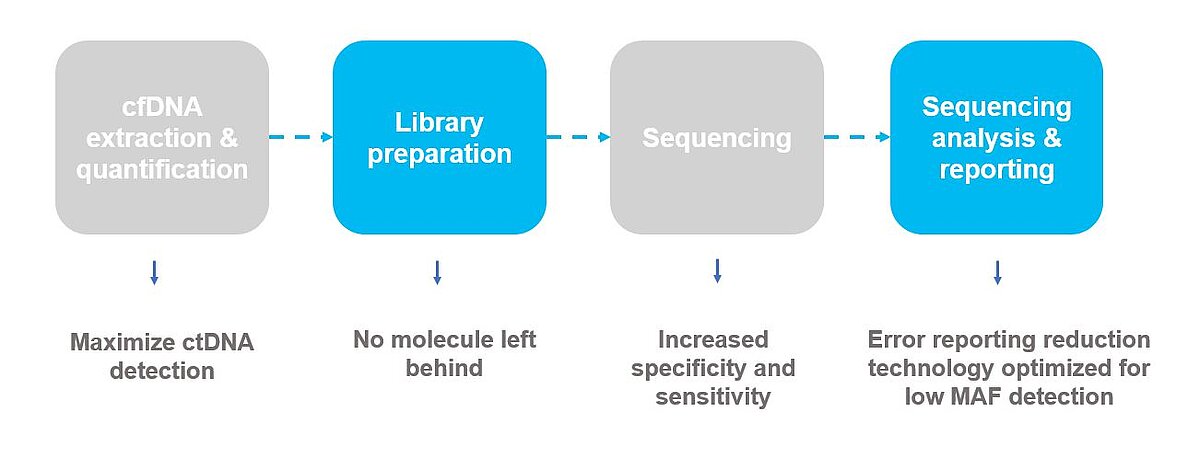
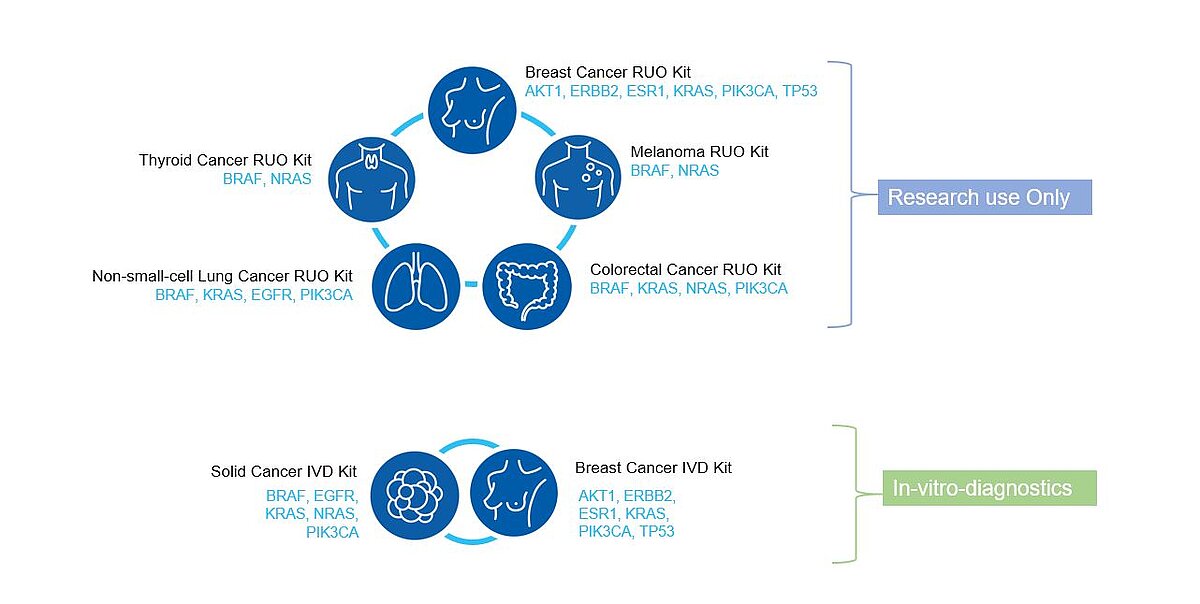
A Sysmex Inostics é a pioneira mundial em biópsia líquida. Foi fundada em 2008 e uniu-se à Sysmex em 2013. Com mais de 10 anos de experiência em biópsia líquida, a Sysmex Inostics é uma parceira de confiança das principais empresas farmacêuticas, alavancando os seus esforços para trazer para os mercados globais as terapias oncológicas personalizadas mais eficazes, desde a descoberta até o diagnóstico complementar.
As nossas soluções em biópsia líquida
References
[1] National Cancer Institute (2022): liquid biopsy
[2] Schmiegel et al. (2017): Mol Oncol. 11(2) : 208 – 219
[3] Saunders et al. (2016): Annals of Onc 27 (6) : 149 – 206
[4] Vidal et al. (2017): J Clin Oncol 35 (suppl 4S; Abstract 607)
[5] Oxnard et al. (2016): J Clin Oncol 34(28):3375-3382
[6] Baselga et al. (2015): Oral pres. SABCS, Abstract S 6 – 01