Calendário Científico 2019 - Maio
Porque é que se recomenda a normalização do rastreio do AL e dos resultados de confirmação contra o intervalo de referência local recomendado?
Porque aumenta a sensibilidade do ensaio.
Porque aumenta a especificidade do ensaio.
Porque aumenta a exatidão dos resultados do doente.
Congratulations!
That's the correct answer!
Sorry! That´s not completely correct!
Please try again
Sorry! That's not the correct answer!
Please try again
Notice
Please select at least one answer
Informação científica de suporte
A síndrome antifosfolipídica (SAF) é uma doença autoimune frequente. Pode ser “primária”, na ausência de outra doença, ou “secundária” caso esteja associada com uma perturbação existente. A SAF encontra-se clinicamente associada a eventos trombóticos venosos e/ou arteriais e a complicações da gravidez que conduzam a perda fetal recorrente, atraso no crescimento e parto prematuro. Em casos raros, os doentes podem desenvolver uma síndrome antifosfolipídica catastrófica (SAFC) caracterizada por trombose multiorgânica e associada a uma elevada taxa de mortalidade [1].
O espetro clínico da SAF é amplo e é essencial facultar a abordagem terapêutica mais apropriada. O diagnóstico da SAF é confirmado se estiverem presentes pelo menos um critério clínico e um critério laboratorial. Caso se obtenham resultados laboratoriais positivos, estes deverão ser confirmados pelo menos 12 semanas após a primeira análise, de forma a evitar a inclusão de falsos positivos no relatório [2].
Os critérios clínicos para SAF encontram-se resumidos na tabela abaixo [1].
| Trombose vascular | Um ou mais episódios clínicos de trombose vascular verificada de forma objetiva |
| Morbilidade na gravidez |
|
O diagnóstico laboratorial envolve principalmente duas abordagens para determinação dos anticorpos antifosfolipídicos [3, 7, 8]:
- a determinação do Anticoagulante Lúpico (AL) por ensaios de coagulação
- a determinação dos anticorpos anticardiolipina (aCL) e/ou anti-β-2-glicoproteína 1 (aβ2GP1) com imunoensaios específicos de fase sólida
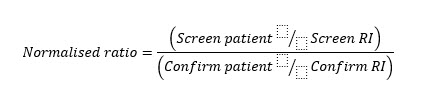
A primeira linha de ensaios para diagnóstico laboratorial da SAF é proposta para medir a atividade anticoagulante dos anticorpos antifosfolipídicos (aFL). As orientações recentes recomendam a utilização de dois testes complementares: dRVVT e TTPA para o diagnóstico do AL. Ambos utilizam concentrações baixas de fosfolípidos para rastreio (por exemplo HEMOCLOT™ LA-S ou CEPHEN™) e concentrações elevadas de fosfolípidos para o ensaio de confirmação (por exemplo HEMOCLOT™ LA-C ou CEPHEN™ LS). Este painel de testes pode ser completado realizando um teste de mistura numa proporção 1:1 de plasma do doente (PD)/pool de plasma normal (PPN) [3, 4, 9, 10]. A realização concomitante de terapia anticoagulante pode interferir com a análise de AL uma vez que o princípio do ensaio se baseia na competição dos anticorpos com os fatores de coagulação dependentes de vitamina K pelos locais de ligação dos fosfolípidos aniónicos. Assim, devem utilizar-se os reagentes com elevada sensibilidade para o AL mas com menos interferência dos anticoagulantes (anti-VKA ou DOACs) [5]. É recomendada a normalização dos resultados do rastreio e ensaios de confirmação contra o intervalo de referência local (IR), através da análise de pelo menos 40 plasmas de sujeitos saudáveis sem qualquer medicação ou doença, uma vez que os resultados dos doentes variam de laboratório para laboratório, dependendo de diferenças relacionadas com os ensaios de coagulação e com os dispositivos [6]. É necessário determinar, para cada lote de amostras, os rácios normalizados calculados dividindo o tempo de coagulação do doente pelo intervalo de referência, de forma a diminuir a variação inter e intraensaio [5]. Uma vez que este número de dadores poderá não estar disponível em todos os laboratórios, a verificação do intervalo de referência do fabricante constitui uma alternativa razoável [6]. Geralmente, os plasmas positivos para o AL apresentam um rácio rastreio/confirmação normalizado >1,20, mas é necessário que cada laboratório determine os valores de corte (Ver Fig. 1).
Os ensaios de segunda linha são imunoensaios para determinar os anticorpos (IgM e IgG) aCL e aβ2GP1. São relevantes dois tipos de anticorpos aCL: os que se ligam à cardiolipina diretamente e os que se ligam à cardiolipina na presença da coproteína β2GP1. Contudo, apenas o último tipo é específico para a SAF; o primeiro encontra-se em doentes com doenças infecciosas como a malária, hepatite ou sífilis. Os ensaios anticardiolipina/anticorpos antifosfolipídicos (ACA/AAF) anteriormente utilizados determinavam os anticorpos contra a cardiolipina na presença de β2GP1 bovina, o que pode conduzir à obtenção de resultados incorretos. Atualmente, estes tipos de ensaios são frequentemente substituídos por ensaios com fosfolípidos aniónicos não oxidados e β2GP1 humana não desnaturada (altamente purificada), conduzindo a uma determinação mais específica e padronizada. Os ensaios específicos anti-β2GP1 que detetam autoanticorpos e que têm como alvo o domínio 1 da β2GP1 específica podem oferecer uma melhor especificidade a uma concentração controlada [5].
Outros testes associados com a SAF são análises para detetar anticorpos dirigidos contra a protrombina, proteína S, proteína C, proteína Z, anexina V e fator XIII. Contudo, devido à falta de padronização e de evidência sobre a sua utilidade clínica em doentes com SAF, não se recomenda a inclusão destes ensaios em painéis de teste padrão.
Basicamente, apenas concentrações moderadas ou elevadas de anticorpos são significativas para o diagnóstico da SAF, ao passo que resultados de fronteira exigem um seguimento para confirmação. Verifica-se uma associação mais forte a eventos trombóticos ou abortos em doentes com dois ou mais resultados positivos para anticorpos contra AL, ACA/AAF ou β2GP1 do que em doentes com resultados positivos em apenas um teste. Recomenda-se fortemente que sejam subsequentemente realizados os três ensaios na mesma amostra e que a análise seja repetida pelo menos 12 semanas após a análise inicial.
Os AFL são muito heterogéneos, com reatividades sobreponíveis em alguns doentes mas não noutros. Assim, são necessários ensaios exatos com características de desempenho bem documentadas para classificação do anticorpo no doente em questão. Apesar de os ensaios se encontrarem mais bem padronizados e serem mais específicos e precisos, são esperadas melhorias adicionais nos próximos anos [5].
Referências bibliográficas
[1] Miyakis S, Lockshin MD, Atsumi T, et al. International consensus statement on an update of the classification criteria for definite antiphospholipid syndrome (APS). J Thromb Haemost. 2006 Feb; 4(2):295–306.
[2] Dlott JS. Diagnosing antiphospholipid antibody syndrome: a review of the criterion for definite APS. Urol Nephrol J 2015; 8(Suppl. 1):18–21.
[3] Devreese KMJ. Antiphospholipid antibody testing and standardization. Int Jnl Lab Hem. 2014; 36:352–363.
[4] Ledford-Kraemer MR, Moore GW, Bottenus R, Daniele C, de Groot PG, Exner T, et al. Laboratory testing for the lupus anticoagulant. 1st ed. Approved guideline. CLSI document H60. Wayne, PA, USA: Clinical and Laboratory Standards Institute; 2014.
[5] Amiral, Peyrafitte, Dunois, Vissace, Seghatchian, et al. Anti-phospholipid syndrome: Current opinion on mechanisms involved, laboratory characterization and diagnostic aspects. Transfusion and Apheresis Science 56 (2017) 612–625.
[6] Clinical and Laboratory Standards Institute. Defining, Establishing and Verifying Reference Intervals in the Clinical Laboratory. 3rd ed. Approved guideline. C28-A3. Wayne, PA, USA: Clinical and Laboratory Standards Institute; 2008.
[7] Sangle NA, Smock KJ. Antiphospholipid antibody syndrome. Arch Pathol LabMed 2011; 135:1092–6.
[8] Pengo V, Banzato A, Bison E, Denas G, Zoppellaro G, Bracco A, et al. Laboratory testing for antiphospholipid syndrome. Int J Lab Hematol 2016; 38(May (Suppl. 1)):27–31.
[9] Moore GW, Culhane AP, Daw CR, Noronha CP, Kumano O. Mixing test specific cut-off is more sensitive at detecting lupus anticoagulants than index of circulating anticoagulant. Thromb Res 2016; 139(March):98–101.
[10] Pengo V, Tripodi A, Reber G, Rand JH, Ortel TL, Galli M, de Groot PG. Update of the guidelines for lupus anticoagulant detection. J Thromb Haemost. 2009; 7:1737–40.