Calendário científico outubro 2024
Monitorização de DAPT utilizando LTA
Como pode utilizar a LTA (agregometria por transmissão de luz) para monitorizar eficazmente a DAPT (terapia antiplaquetária dupla)?
Determinar a agregação máxima de plaquetas em % a partir de uma única concentração de agonista do ácido araquidónico
Determinar o TP em INR
Determinar a pontuação APAL e CPAL
Congratulations!
That's the correct answer!
Sorry! That´s not completely correct!
Please try again
Sorry! That's not the correct answer!
Please try again
Notice
Please select at least one answer
Informação científica de suporte
Atualmente, existem muitas ferramentas disponíveis que ajudam na avaliação da função plaquetária. O método mais estabelecido e conhecido é a agregometria por transmissão de luz (LTA) segundo Born. Este método de medição foi desenvolvido em 1963 e é o método padrão para investigações sobre doenças hereditárias da função plaquetária. [1, 2] A medição baseia-se numa alteração da transmissão de luz do plasma rico em plaquetas devido à ativação e agregação das plaquetas após a adição de um agonista plaquetário. [1] Embora limitado pelas orientações apenas para fins de investigação, o LTA também pode ser utilizado para monitorizar a terapia antiplaquetária. [3]
A terapia antiplaquetária dupla com clopidogrel ou outro inibidor P2Y12 e aspirina demonstrou ser uma estratégia de tratamento estabelecida e recomendada pelas orientações para o tratamento de doentes com doença cardiovascular. Sabe-se que o efeito farmacológico dos medicamentos antiplaquetários varia entre indivíduos. Está descrito que muitos indivíduos não respondem ao clopidogrel devido a polimorfismos no gene CYP2C19. [4–6] O efeito antiplaquetário da aspirina é reduzido em doentes com a chamada ‘resistência à aspirina’ devido a polimorfismos de nucleotídeo único (SNP) que afetam a COX-1 e a função plaquetária, inflamação e síndrome metabólica. [7–9]
Nos últimos anos, o método LTA tornou-se mais padronizado graças a analisadores de coagulação totalmente automatizados CS-Series (exceto CS-1600) e CN-Series (todos da Sysmex Corporation, Kobe, Japão), que reduzem significativamente a intervenção manual pelo operador, melhorando a precisão e repetibilidade dos resultados.
Tabela 1 LTA utilizando um analisador semi-automático vs. analisadores das CS-Series e CN-Series
| Semi-automático | Passos de operação | CN-/CS-Series |
| Manual | Colheita e preparação manual da amostra de sangue | Manual |
| Manual | Preparação manual da cuvete de agitação | Minimizado |
| Manual | Dispensa da amostra | Automatizado |
| Manual | Diluição do agonista | Automatizado* |
| Manual | Dispensa do agonista | Automatizado |
| Automatizado | Deteção da agregação | Automatizado |
| Automatizado | Saída de resultados | Automatizado |
* apenas CN-Series
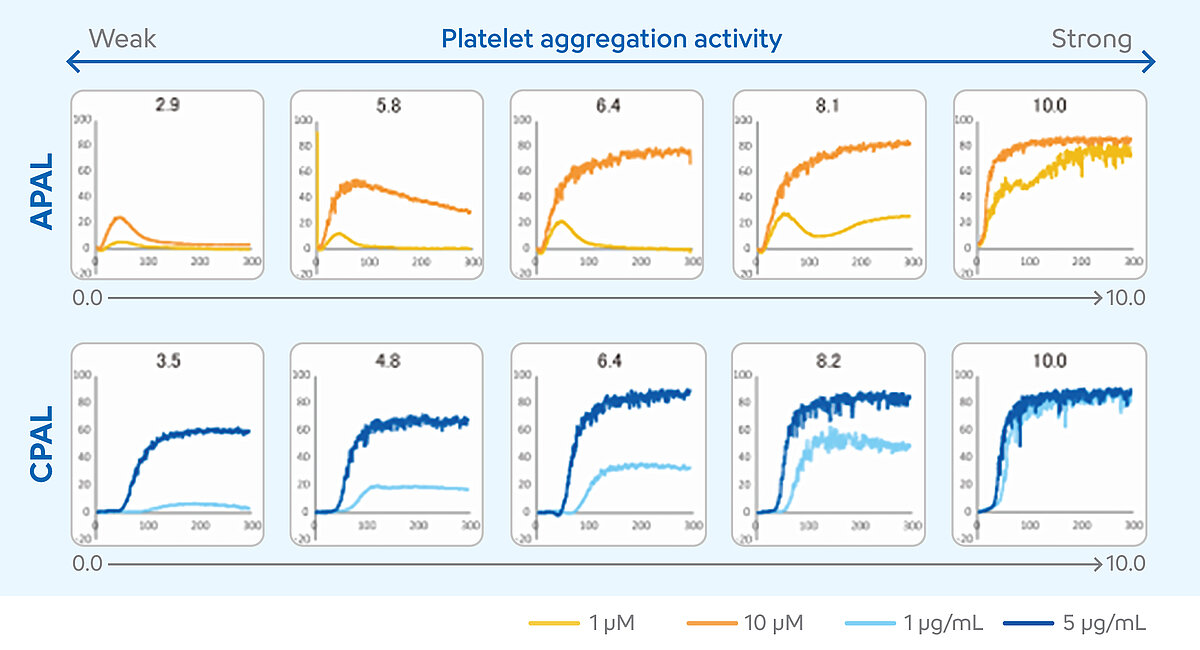
A interpretação dos resultados das medições de LTA exige um elevado grau de especialização. Devem ser incluídos na avaliação de casos individuais diversos resultados numéricos e a progressão da curva. Nos últimos anos, estas condições limitaram a utilização do LTA na monitorização da terapia antiplaquetária dupla (DAPT). Para resolver este problema e facilitar a interpretação dos resultados, foi desenvolvido o método de duas concentrações de agonista para os analisadores da CS-Series e da CN-Series. [10] Neste método, amostras dos doentes são medidas com duas concentrações de um agonista sensível à aspirina e de um agonista sensível ao inibidor de P2Y12. Os resultados das duas concentrações são traduzidos numa pontuação, o nível de agregação plaquetária (PAL). Esta pontuação pode ser utilizada para estimar se a DAPT é suficientemente eficaz ou se o doente pode necessitar de um ajuste da terapêutica. O PAL é uma função adicional do analisador e utiliza os agonistas plaquetários ADP como agonista sensível ao inibidor de P2Y12 e colagénio como agonista sensível à aspirina. O PAL induzido por ADP (APAL) é calculado a partir dos resultados de medição em concentrações de 1 µM e 10 µM, e o PAL induzido por colagénio (CPAL) a partir dos resultados de medição em concentrações de 1 µg/ml e 5 µg/ml. Tanto o APAL como o CPAL são calculados utilizando a área sob a curva (AUC). [11-13]
As pontuações podem variar de 0 a 10. Valores de pontuação PAL mais elevados indicam níveis mais altos de agregação plaquetária, sugerindo uma resposta fraca ou ausente à DAPT, enquanto valores mais baixos de pontuação PAL indicam níveis mais baixos de agregação plaquetária, sugerindo uma resposta adequada à DAPT. [14]
Estudos sobre as pontuações PAL em analisadores CS-Series e CN-Series revelaram uma imprecisão inferior a 5% em amostras tratadas com aspirina (CPAL) ou com o inibidor de P2Y12 cangrelor (APAL) num analisador CN-Series, e inferior a 10% para amostras tratadas com cangrelor (APAL) e inferior a 5% em amostras tratadas com aspirina (CPAL) num analisador CS-5100. Os resultados PAL correlacionam-se bem entre ambas as séries de analisadores, como apresentado na Tabela 2. [14, 15]
Tabela 2 Correlação entre CN-6000 e CS-5100
| Agonista | Concentração | N | Coeficiente T | |
| ADP | 1 µM | 85 | 0,988 | y = 1,00x + 3,85 |
| 10 µM | 85 | 0,955 | y = 0,89x + 11,44 | |
| Pontuação APAL | 85 | 0,971 | y = 0,91x + 0,94 | |
| Colagénio | 1 µg/mL | 82 | 0,996 | y = 1,02x - 0,83 |
| 5 µg/mL | 82 | 0,972 | y = 0,99x + 0,66 | |
| Pontuação CPAL | 82 | 0,994 | y = 1,00x - 0,08 |
Outros estudos demonstraram uma sensibilidade melhorada do sistema PAL em comparação com a utilização convencional do LTA sem um sistema de pontuação. Verificou-se que a pontuação PAL reduziu a variabilidade no mesmo sujeito e demonstrou ser mais fiável para medir a eficácia dos medicamentos antiplaquetários do que a agregação máxima de plaquetas em % numa única concentração de agonista. [16]
Estão atualmente em curso mais investigações para estabelecer valores de corte para a monitorização da terapia antiplaquetária utilizando a pontuação PAL, que idealmente reduzirá significativamente a recorrência de eventos trombóticos durante o tratamento.
Referências
[1] Born GV. (1962): Aggregation of blood platelets by adenosine diphosphate and its reversal. Nature. 194: 927–929.
[2] Kang J, Park KW, Palmerini T, et al. (2019): Racial Differences in Ischaemia/Bleeding Risk Trade-Off during Anti-Platelet Therapy: Individual Patient Level Landmark Meta-Analysis from Seven RCTs. Thromb Haemost. 119 (1): 149–162.
[3] Cattaneo M, Cerletti C, Harrison P, Hayward CPM, Kenny D, Nugent D, Nurden P, Rao AK, Schmaier AH, Watson SP, Lussana F, Pugliano MT, Michelson AD. (2013): Recommendations for the standardization of light transmission aggregometry: a consensus of the working party from the platelet physiology subcommittee of SSC/ISTH. J Thromb Haemost; 11:1183–1189.
[4] Cattaneo M. (2010): New P2Y(12) inhibitors. Circulation. 121 (1): 171–179.
[5] Bonello L, Tantry US, Marcucci R, et al. (2010): Consensus and future directions on the definition of high on-treatment platelet reactivity to adenosine diphosphate. J Am Coll Cardiol. 56 (12): 919–933.
[6] Tantry US, Bonello L, Aradi D, et al. (2013): Consensus and update on the definition of on-treatment platelet reactivity to adenosine diphosphate associated with ischemia and bleeding. J Am Coll Cardiol. 62 (24): 2261–2273.
[7] Colantonio LD, Gamboa CM, Kleindorfer DO, et al. (2016): Stroke symptoms and risk for incident coronary heart disease in the REasons for Geographic And Racial Differences in Stroke (REGARDS) study. Int J Cardiol. 220: 122–128.
[8] Cattaneo M. (2007): Resistance to antiplatelet drugs: molecular mechanisms and laboratory detection. J Thromb Haemost. 5, Suppl 1: 230–237.
[9] Cattaneo M. (2004): Aspirin and clopidogrel: efficacy, safety, and the issue of drug resistance. Arterioscler Thromb Vasc Biol. 24 (11): 1980–1987.
[10] Matsuo T, Ohki Y. (1977): Classification of platelet aggregation patterns with two ADP solutions (the double-ADP method) and its clinical application to diabetes mellitus. Thromb Res. 11 (4): 453– 461.
[11] Sakayori T, Watanabe Y, Kitano K, et al. (2019): Evaluating the Utility of a Novel Research Use Index in Platelet Aggregation Analysis Featured in an Automated Blood Coagulation Analyzer to Confirm the Effect of Antiplatelet Drugs. Sysmex J Int. 2019; 29 (1): 39–47.
[12] Omori Y, Ishida H, Sakayori T, et al. (2019): Evaluation of Fully Automated Blood Coagulation Analyzer Equipped with a Novel Analysis Method – Antiplatelet Responsive Index –. Rinsho Byori. 67 (3): 205–211.
[13] Sadakata T, Sakayori T, Watanabe Y, et al. (2018): Basic Evaluation of PAL Which is a Research Use Index for Confirming the Effect of Antiplatelet Drugs Installed in the CS Series and Comparison Study with the Index Installed in Existing Instrument. Sysmex J. 2018; 19 (2): 1–10.
[14] Sakayori T, et al. (2024): Analytical Evaluation of Platelet Aggregation Level on a Fully Automated Coagulation Analyzer CN-6000, and a Case Study of an Initial Absorbance of Platelet-rich Plasma. Sysmex Journal International Volume 34 No.1. Published 12 June 2024.
[15] Shimizu M, et al. (2019): Evaluation of a new analysis index of platelet aggregation test using CS-5100 with G-Type on a PRP313M. Japanese Journal of Medical Technology, Volume 68, Issue 3, Pages 501–506.
[16] Lecchi A, Capecchi M, Padovan L, Artoni A, Arai N, Shinohara S, La Marca S, Peyvandi F. (2024): Evaluation of an automated platelet aggregation method for detection of congenital or acquired platelet function defects. Blood Transfus. 22(4):350–359.