Calendário científico de dezembro de 2024
Leucemia mieloide aguda (LMA)
Quais são as características dos blastos no canal WPC após o tratamento com reagentes?
Os blastos não são fortemente permeados pelo reagente de lise e, portanto, apresentam sinais de fluorescência baixos e sinais altos de tamanho celular.
.
Os blastos são fortemente lisados, causando sinais de fluorescência mais altos e sinais de tamanho mais fracos.
Os blastos encolhem durante o tratamento com reagentes, produzindo sinais de fluorescência baixos e sinais de tamanho menor.
Congratulations!
That's the correct answer!
Sorry! That´s not completely correct!
Please try again
Sorry! That's not the correct answer!
Please try again
Notice
Please select at least one answer
Informação científica de suporte
Leucemia mieloide aguda
A leucemia mieloide aguda (LMA) é o tipo mais comum de leucemia aguda em adultos e é caracterizada pela proliferação clonal de células precursoras mieloides na medula óssea [1]. A maior incidência de LMA é observada na Europa, particularmente no Reino Unido, com uma incidência de 4,05 por 100.000 pessoas. No entanto, a LMA é considerada uma doença rara e afeta principalmente os idosos [1]. Em 97% dos casos de LMA, surgem alterações genéticas nos precursores de células estaminais da linhagem mieloide, resultando em alterações neoplásicas e proliferação clonal [2]. Essas mutações são heterogéneas e apresentam uma variedade de anomalias citogenéticas e moleculares em diferentes classes funcionais [3]. A OMS definiu um valor de referência para o diagnóstico de LMA que requer a presença de pelo menos 20% de blastos mieloides no sangue periférico ou na medula óssea [4]. Diagnosticar e monitorizar a LMA exige uma abordagem abrangente que inclui análises hematológicas e morfológicas, citometria de fluxo clínica e testes moleculares.
Deteção de blastos com os canais WDF e WPC da Sysmex
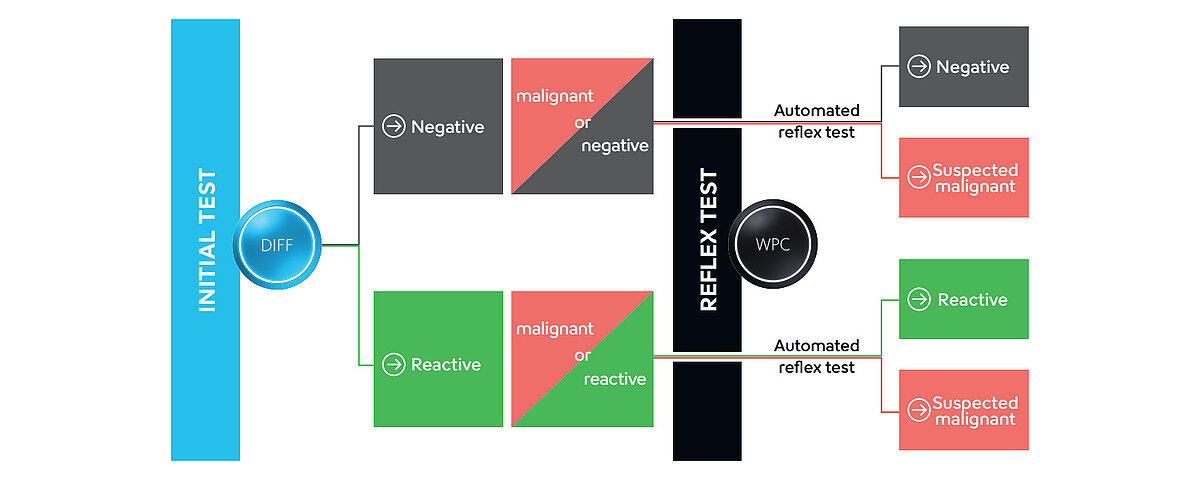
A análise CBC+DIFF clássica em analisadores hematológicos de rotina da Sysmex fornece uma indicação inicial da presença de células anómalas. A mesma pode ser complementada por informações adicionais obtidas no canal de “célula branca percursora e patológica” (WPC).
As membranas dos leucócitos (WBC) são compostas de forma diferente, dependendo da sua maturidade, função e estado de ativação. O canal diferencial de leucócitos (WDF) utiliza um marcador de fluorescência que consegue separar subtipos de leucócitos conforme essas diferenças na composição da membrana e conteúdo citoplasmático. O reagente de lise reage de forma suave, perfurando a membrana celular e deixando a estrutura interna das células largamente intacta. Tal permite que o marcador de fluorescência entre na célula e marque principalmente o ARN. Consoante o sinal de fluorescência dos agregados celulares, são acionados sinais específicos, pré-classificando a amostra como negativa, reativa ou potencialmente maligna. Com base nesta pré-classificação no canal de medição WDF, podem ser ativados os marcadores "Blasts/Abn Lympho?" (blastos/linfócitos anómalos?) ou a combinação "Blasts/Abn Lympho?" e "Atypical Lympho?" (linfócitos atípicos?), levando a uma medição reflexa automática no canal WPC (Fig. 1).
Comparativamente com o canal WDF, o reagente de lise do canal WPC tem um impacto mais forte nos lípidos da membrana, resultando numa maior permeabilidade da membrana celular. Com a maior concentração de polimetina do reagente de fluorescência do WPC do que a do canal WDF, o reagente marca o ADN no núcleo em vez do ARN citoplasmático. As características especiais de diferentes leucócitos podem ser utilizadas para diferenciar subpopulações, por exemplo, entre linfócitos anómalos e células blásticas (Fig. 2).
A LMA é caracterizada pela presença de células blásticas da linhagem mieloide. As células blásticas apresentam uma baixa composição lipídica, o que as torna mais resistentes à lise celular, mesmo com o forte reagente de lise do WPC. A permeabilidade celular é reduzida, resultando num sinal de fluorescência mais baixo combinado com um sinal elevado de tamanho celular, uma vez que as células permanecem maioritariamente intactas. Estas características permitem uma identificação fiável das células blásticas no canal WPC.
As amostras sinalizadas durante a medição WDF são submetidas a análise reflexa e a anomalia é então classificada mais especificamente com um sinal mais específico (por exemplo, “Blast?” ou “Abn Lympho?”) ou o sinal é removido totalmente.

As amostras suspeitas de malignidades hematológicas, como a LMA, passam por análises especializadas adicionais. Através da imunofenotipagem por citometria de fluxo, as células suspeitas são caracterizadas em maior detalhe através da utilização dos marcadores específicos de superfície e intracelulares destas células. No laboratório molecular, podem ser avaliadas mutações específicas através de técnicas citogenéticas como a hibridação fluorescente in situ (FISH) e sequenciação de nova geração (NGS).
Incluir estas disciplinas permite aos clínicos combinar dados de vários testes, conduzindo a uma compreensão abrangente do estado do doente e à identificação de uma estratégia de tratamento eficaz e direcionada de forma individual.
Resultados do caso
Uma doente de 70 anos estava a realizar vários ciclos de quimioterapia e radioterapia para carcinoma pulmonar de células não pequenas. Apresentou-se numa clínica de ambulatório após desenvolver mal-estar e uma diminuição marcada de energia. Exames hematológicos num analisador XR-Series revelaram inicialmente anemia, trombocitopenia e leucocitose ligeira (Fig. 3).
O sinal “IG Present” (IG presente) foi acionado no canal WDF. A contagem de granulócitos imaturos (IG) inclui promielócitos, mielócitos e metamielócitos, sendo especialmente relevante em doentes altamente suscetíveis a infeções devido a um sistema imunitário suprimido, por exemplo, devido à quimioterapia. A presença de granulócitos imaturos indica a severidade da resposta imunológica inata precoce.
Além disso, o analisador acionou o sinal “Blasts?” do canal WPC e o respetivo diagrama de dispersão mostrou um aumento de células na área de blastos (Fig. 4). Este achado indica a presença de doenças malignas agudas, como leucemia mieloide ou linfoblástica.
Subsequentemente, foi realizada uma revisão da amostra para inspecionar a morfologia e a contagem das células, revelando que 75% eram células blásticas. A imunofenotipagem posterior no laboratório clínico de citometria de fluxo confirmou a suspeita de LMA.
Referências
[1] Dong Y et al. (2020): Leukemia incidence trends at the global, regional, and national level between 1990 and 2017. Exp Hematol Oncol; 9:14.
[2] Pelcovits A et al. (2020): R I Med J; 103(3). Acute Myeloid Leukemia: A Review.
[3] Kayser S et al. (2023): The clinical impact of the molecular landscape of acute myeloid leukemia. Haematologica; 108(2):308–320.
[4] Khoury JD et al. (2022): The 5th edition of the World Health Organization Classification of Haematolymphoid Tumours: Myeloid and Histiocytic/Dendritic Neoplasms. Leukemia; 36(7), 1703–1719.